Phương pháp giải nhanh dạng toán: Kim loại/ oxit kim loại + Axit
Cách phương pháp giải nhanh dạng toán: Kim loại/ oxit kim loại + Axit
Kim loại + H2SO4/ HCl loãng
Hỗn hợp kim loại X phản ứng với HCl/ H2SO4 loãng sinh ra a (g) khí H2 hay V lít khí. Yêu cầu tính lượng muối tạo thành (hay muối khan/ rắn sau khi cô cạn).
CÔNG THỨC:
m(muối) = m(hỗn hợp kim loại X) + 96 * nH2 (với H2SO4 loãng)
m(muối) = m(hỗn hợp kim loại X ) + 71 * nH2 (với HCl)
Ví dụ:
a) Cho 11,4 gam hh gồm 3 kim loaị Al, Mg, Fe phản ứng hết với H2SO4 loãng, thu được 10,08 lít H2 (đkc). Cô cạn dd thu được m gam rắn. Vậy m có thể bằng:
Áp dụng: m(muối rắn) = m(hh kim loại) + 96 * nH2 = 11,4 + 96 * (10,08/22,4) = 54,6g
b) Cho 20g hỗn hợp bột Mg, Fe tác dụng hết với dung dịch HCl thấy có 1 gam khí thoát ra. Lượng muối clorua tạo thành là bao nhiêu gam?
Áp dụng: m(muối) = m(hh kim loại) + 71 * n(khí) = 20 + 71 * (1/2) = 55,5 g (hiểu ngầm khí là H2)
Kim loại + HNO3 (đặc/ loãng)
Dạng 1: Kim loại (đã biết tên và khối lượng) phản ứng với … Yêu cầu tính V lít (hỗn hợp) khí sinh ra. Hoặc tính số mol khí sinh ra.
Dạng 2: Kim loại M (chưa biết tên) phản ứng với …sinh ra V lít (hỗn hợp) khí (hay số mol khí đã biết). Yêu cầu tìm tên kim loại M.
Dạng 3: Kim loại (đã biết tên nhưng chưa biết khối lượng) phản ứng với … sinh ra V lít (hỗn hợp) khí (hay số mol). Yêu cầu tính m khối lượng kim loại phản ứng.
CÔNG THỨC :
n(e cho) = (mkim loại/ Mkim loại) * hóa trị (của kim loại)
ne nhận = 1*nNO2 + 3* nNO + 8*nN2O + 10 *nN2 (PỨvới HNO3).
= 2*nSO2 + 6*nS + 8*nH2S (PỨ với H2SO4 đặc, thường gặp SO2)
= 2*nH2 (PỨ với H2O, H2SO4/ HCl loãng hay NaOH,…). Không có chất nào, cho nó bằng 0.
Sau đó, cho n(e cho) = n(e nhận) rồi giải phương trình.
Ví dụ:
a) Cho 4,05g Al tan hết trong d/d HNO3 sinh ra V lít . Tính V. (dạng 1)
* Áp dụng: n(e cho) = (mAl/ MAl) * hóa trị (Al) = (4,05/27) * 3 = 0,45mol
n(e nhận) = 8*N2O = 8 * (VN2O/22,4)
Cho n(e cho) = n(e nhận) => 0,45 = 8 * (VN2O/22,4) => V= 1,26 lít.
* Tính nhanh: Cho n(e cho) = n(e nhận)
(mAl/ MAl) * hóa trị (Al) = 8*N2O
(4,05/27) * 3 = 8 * (VN2O/22,4) => V=1,26l.
b) Đem 15g hh (Al, Zn) tác dụng HNO3 đặc, nguội, dư thì thu được 2g chất rắn. Thể tích khí NO2sinh ra (ở đkc) là : (dạng 1)
Lưu ý: Al, Cr, Fe không PỨ với HNO3/ H2SO4 đặc nguội nên bài này chỉ có Zn phản ứng và chất rắn còn lại là Al. mZn pứ = mhh – mAl sau pứ = 15 – 2=13g.
Áp dụng: Cho ne cho = ne nhận
(mZn/ Mzn) * hóa trị (Zn) = nNO2
(13/65) * 2 = (VNO2/22,4) => V= 8,96 lít.
c) Hòa tan m(g) Al vào d/d HNO3 loãng thu được hỗn hợp khí gồm 0,1mol N2 và 0,01mol NO. Tính m. (dạng 3)
Áp dụng: Cho ne cho = ne nhận
(mAl/ MAl) * hóa trị (Al) = (10*nN2 + 3*nNO)
(mAl/27) * 3 = (10*0,1 + 3*0,01) => mAl = 9,27g
d) Cho 2,7g kim loại Al t/d với NaOH dư thu được V lít khí H2. Tính V (dạng 1)
Áp dụng: Cho ne cho = ne nhận
(mAl/ MAl) * hóa trị Al = 2*nH2
(2,7/27) * 3 = 2*(VH2/ 22,4) => V = 3,36lít.
e) Cho 5,4g kim loại X t/d với HCl dư thu được 6,72 lít khí H2. Tên X? Biết X có hóa trị III. (dạng 2).
Áp dụng: Cho ne cho = ne nhận
(mX/ MX) * hóa trị X = 2*nH2
(5,4/Mx) * 3 = 2*(6,72/ 22,4) => MX = 27 => X là Al.
* BÍ QUYẾT: khi nhắc đến Al thì nhớ 4 con số 2,7g ; 5,4g ; 1,08g; 10,8g hay gặp (và ngược lại, đề bài có 4 con số này nhưng yêu cầu tìm tên kim loại, hãy nghĩ đến Al. Hoặc kim loại hóa trị III => Al)
f) Cho 6,4g kim loại A t/d hết H2SO4 đặc nguội sinh ra 6,4 gam SO2. Hỏi kim loại A? (dạng 2). Đáp án: Cu – Fe – Al – Zn
Nhìn liếc qua 4 đáp án thì phần lớn là kim loại hóa trị II.
Áp dụng: Cho n(e cho) = n(e nhận)
(mA/ MA) * hóa trị A = 2*nSO2
(6,4/MA) * 2 = 2*(6,4/64) => MA = 64 => A là Cu.
*BÍ QUYẾT : thấy số 6,4 g hay 0,64g thì hãy nghĩ đến Cu.
* Loại trừ: Fe/ Al/ Cr không phản ứng với H2SO4/ HNO3 đặc nguội -> loại. Khi PỨ thấy sinh raN2/ N2O hoặc S, H2S thì nhớ đến 3 kim loại sau: Al/ Mg/ Zn (thần chú: Áo mỏng dính). Trong vd f, thấy sinh ra SO2 (ko phải S hay H2S) nên loại Zn. Vậy chỉ còn là Cu là đáp án.
g) Cho m (g) Fe phản ứng với HCl loãng sinh ra 0,2g khí. Tính m. (dạng 3)
Áp dụng: Cho n(e cho) = n(e nhận)
(mFe/ MFe) * hóa trị Fe = 2*nH2
(mFe/56) * 2 = 2*(0,2/2) => mFe = 5,6g.
* BÍ QUYẾT : khi thấy Fe thì nghĩ đến số 5,6g (và ngược lại, đề cho 5,6g và hỏi kim loại gì thì nghĩ đến Fe).
Tương tự: khi thấy Kali thì 3,9g hay 0,39g. Nói chung là con số m có liên quan đến M của kim loại đó
* Lưu ý: Fe với HNO3/ H2SO4 đặc thì có hóa trị III, còn HCl/ H2SO4 loãng thì có hóa trị II.
Hỗn hợp kim loại X + HNO3 (đặc/ loãng)
- Yêu cầu tính khối lượng muối (hay muối rắn/ khan sau khi cô cạn) biết V lít khí sinh ra.
m(muối) = m(hỗn hợp kim loại X) + 62 * n(e nhận) (với HNO3) với ne nhận tính như trên
Ví dụ: Cho 2,06g hỗn hợp gồm Fe, Al, Cu tác dụng với dd HNO3 loãng dư thu được 0,896 lít NO duy nhất (đkc). Khối lượng muối nitrat sinh ra là:
A. 9,5g. B. 7,54g. C. 7,44g. D. 1,02g.
Key: m(muối nitrat) = m(hỗn hợp kim loại) + 62 * n(e nhận) ( với ne nhận = 3* nNO)
= 2.06 + 62 * 3 * (0,896/22,4) = 9,5g
* BÍ QUYẾT: hai số 7,54g ; 7,44g na ná nhau ở số 7 nên loại 2 cái đi. Loại 1,02 đi vì khối lượng muối sau phản ứng phải lớn hơn 2,06g (do cộng thêm). Vậy còn đáp án 9,5g.
Hỗn hợp oxit kim loại + H2SO4 loãng
Tính lượng muối sunfat tạo thành.
Key: m(muối sunfat) = m(hỗn hợp oxit kim loại) + 80 * nH2SO4
Ví dụ: Cho 32 gam hỗn hợp oxit gồm MgO, FeO, CuO t/d với 300ml dung dịch H2SO4 2M dư. Cô cạn dung dịch sau PỨ thu được m(g) muối khan. Tính m. Đáp án: 30 -31 – 32 – 80
* BÍ QUYẾT: khối lượng muối thu phải lớn hơn khối lượng ban đầu (do cộng). Vì vậy 30,31 loại đi. Còn số 32, thì ko có chuyện khối lượng trước và sau như nhau -> còn 80 là đáp án. Các bạn có thể áp dụng công thức tính.
Hỗn hợp oxit kim loại + CO/ H2
Tính khối lượng chất rắn/ kết tủa thu được.
Key: m(rắn) = m(hỗn hợp oxit kim loại) – 16 * nCO/H2
Ví dụ: a) Khử hoàn toàn 45 g hỗn hợp gồm CuO, FeO, ZnO cần dùng vừa đủ 8,4 lít khí CO. Tính khối lượng chất rắn thu được. Các đáp án: 46 – 44,46 – 37,65 – 39 (ĐH A 2007-2008-2009)
m(rắn) = m(hỗn hợp oxit kim loại) – 16 * nCO = 45 – 16 * (8,4/22,4) = 39g
* BÍ QUYẾT: Thấy số thập phân và số nguyên -> chọn số nguyên (dạng toán oxit, khi hỏi khối lượng thường là số nguyên) => chọn 46 hay 39.
Vì khối lượng chất rắn sau PỨ phải giảm (do trừ bớt) nên nó nhỏ hơn khối lượng ban đầu -> loại 46 vì 46>45. Vậy còn D là 39g. Các ví dụ ở trên thì khối lượng muối sau PỨ lớn hơn ban đầu.
b) Khử m(g) hỗn hợp oxit kim loại Fe2O3, Fe3O4, FeO, CuO. Tính m(g) biết sau PỨ thu được 26 gam chất rắn và 5,6 lít hỗn hợp CO2 và H2O.
Key: mrắn = mhỗn hợp oxit kim loại – 16 * nCO/H2 26 = mhh – 16 * (5,6/22,4) mhh =30g.
Nhớ: n(CO/ H2) = n(H2O/ CO2) hay nCO= nCO2 hay nH2 = nH2O
c) Cho khí H2 khử hoàn toàn đến Fe một hỗn hợp gồm các oxit sắt, thấy sau PỨ sinh ra 4,48 lít hơi nước. Tính thể tích khí H2 cần dùng để khử.
Ta có: nH2 = nH2O => VH2 = VH2O = 4,48 lít.
Hỗn hợp muối cacbonat + HCl loãng
Tính khối lượng muối clorua tạo thành
Key: m(muối clorua) = m(hh muối cacbonat) + 11 * n(khí CO2)
Ví dụ: Hòa tan hết 5g hỗn hợp 2 muối cacbonat trong dung dịch HCl dư thu được 1,68 lít khí. Cô cạn dung dịch sau phản ứng. Tính khối lượng muối khan tạo thành. Đáp án: 5,825g – 10,8g – 4,75g – 5g
m(muối clorua) = m(hh muối cacbonat) + 11 * n(khí CO2) = 5 + 11 * (1,68/22,4) = 5,825g
* BÍ QUYẾT : loại số 10,8g đi vì nó quá lớn (theo công thức nó tăng có 11*nkhí thôi) nên loại. Còn số 4,75g
2. Cách tạo đề thi trắc nghiệm Hóa học trên AZtest
- Bước 1: Bạn cần đăng ký khởi tạo tài khoản trên hệ thống AZtest tại đây.
-
Bước 2: Sau khi khởi tạo thành công, hệ thống sẽ gửi đến email bạn đã đăng ký tài khoản và mật khẩu. Bạn sử dụng tên đăng nhập và mật khẩu đó để đăng nhập tài khoản trên AZtest.
- Bước 3: Bạn tiến hành biên soạn đề thi trắc nghiệm môn Hóa học trên AZtest theo các hướng dẫn tại đây
Để giúp các bạn hình dung dễ dàng hơn về cách tạo đề thi trắc nghiệm, AZtest đã tạo bộ đề thi mẫu: Đề thi 15 phút môn Hóa học. Bộ đề thi bao gồm 10 câu hỏi, thời gian làm bài 15 phút và được tính theo thang điểm 10.
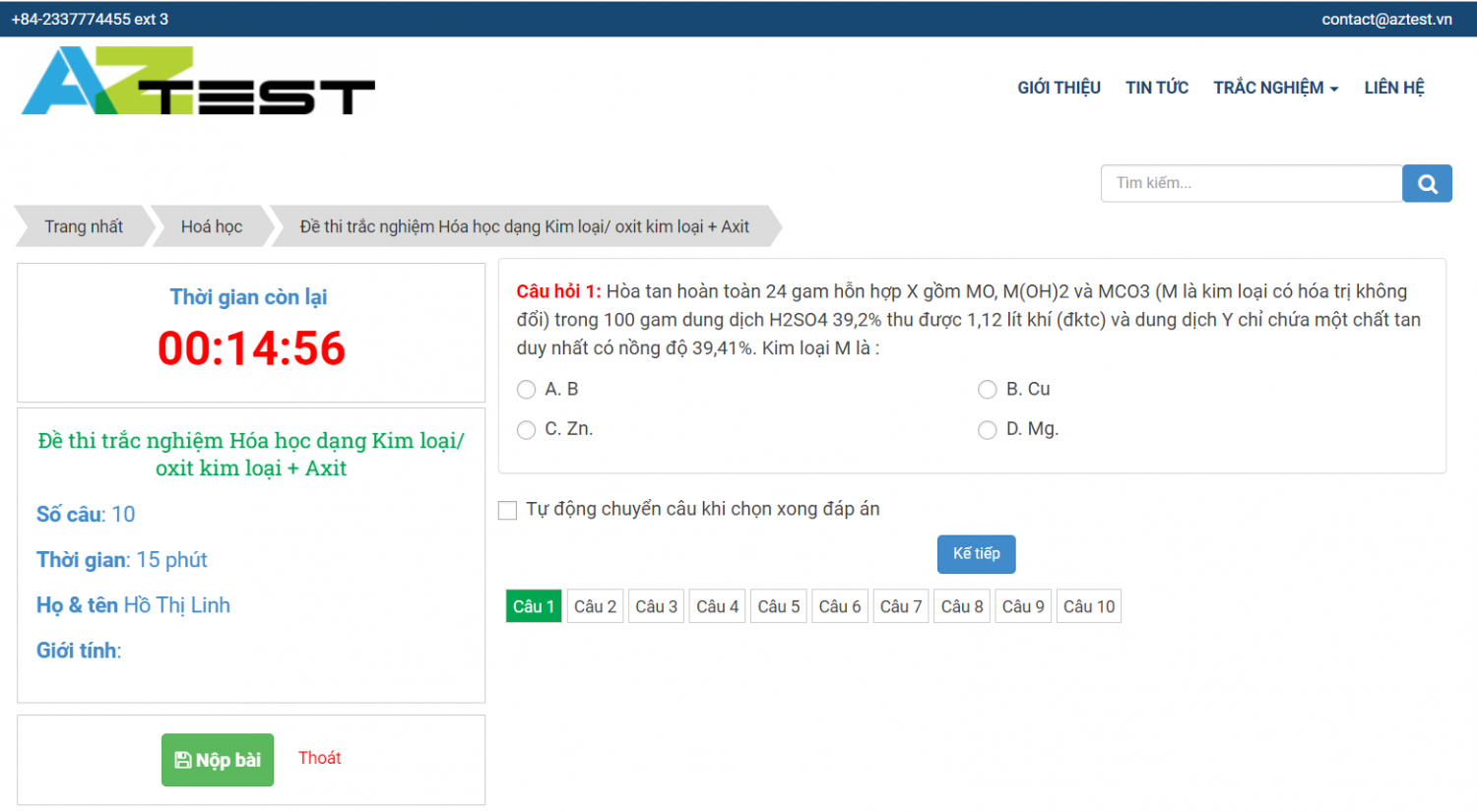
Bạn có thể tham khảo bộ đề thi này tại đây để có thể tạo ra một ngân hàng đề thi trắc nghiệm lý thuyết môn Vật Lý 12 được phong phú và chất lượng hơn.
Bài viết trên AZtest đã chia sẻ đến bạn các phương pháp giải nhanh dạng toán kim loại/oxit kim loại + axit cũng như hướng dẫn cho thầy cô cách tạo đề thi trắc nghiệm online môn hóa học trên AZtest. Hy vọng rằng những chia sẻ trên sẽ giúp ích cho thầy cô ít nhiều trong quá trình hướng dẫn học sinh của mình.
Trong quá trình tạo đề nếu có điều gì thắc mắc cần tư vấn hãy liên hệ ngay với chúng tôi theo số hotline 0233 777 4455 hoặc inbox Fanpage www.facebook.com/aztest.vn để được nhân viên hỗ trợ, tư vấn hướng dẫn tận tình nhất.
AZtest là hệ thống tạo lập website thi trắc nghiệm trực tuyến do CÔNG TY TNHH PHÁT TRIỂN VÀ DỊCH VỤ NGUỒN MỞ THUẬN ĐỨC phát triển. Với AZtest, người dùng có thể dễ dàng sở hữu một website tổ chức ôn tập, thi trắc nghiệm trực tuyến hoàn toàn miễn phí, độc lập, được cá nhân hóa theo yêu cầu của người quản trị.
Liên hệ hotline 02337774455 hoặc Fanpage https://m.me/aztest.vn để được tư vấn trực tiếp bởi đội ngũ kỹ thuật viên của AZtest.
Nguồn tin: Sưu tầm
Những tin mới hơn
Những tin cũ hơn




